

Radio K55
Data di pubblicazione: 10/07/2025 alle 16:43
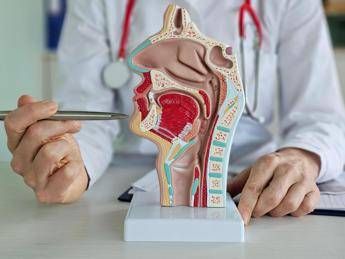
(Adnkronos) – La Commissione europea ha approvato tislelizumab, in combinazione con gemcitabina e cisplatino, per il trattamento di prima linea dei pazienti adulti con carcinoma rinofaringeo (Npc) recidivante o metastatico, non suscettibile di intervento chirurgico o radioterapico curativo. Lo annuncia BeOne Medicines Ltd, azienda oncologica a livello globale, in una nota in cui ricorda che il carcinoma rinofaringeo è un tumore raro le cui cellule maligne hanno origine nel rinofaringe, la parte superiore della gola dietro il naso. "L'approvazione di tislelizumab in combinazione con chemioterapia in Europa costituisce un importante passo avanti per i pazienti con carcinoma rinofaringeo recidivante o metastatico, una malattia rara e difficile – afferma Lisa Licitra, responsabile Oncologia medica 3 – Tumori della testa e del collo, Fondazione Irccs Istituto nazionale dei tumori di Milano – Grazie ai risultati convincenti dello studio Rationale-309, oggi abbiamo un nuovo potente trattamento che non solo permette di ritardare la progressione di malattia, ma che aiuta i pazienti a vivere più a lungo. Questa approvazione offre una nuova speranza e un'opzione clinicamente testata ai pazienti che necessitano urgentemente di cure migliori". L'approvazione nel carcinoma rinofaringeo – illustra l'azienda in una nota – si basa sui risultati dello studio multicentrico di fase 3 Rationale-309, in doppio cieco, controllato da placebo, che ha randomizzato 263 pazienti naïve al trattamento che hanno ricevuto tislelizumab in combinazione con gemcitabina più cisplatino o placebo in associazione a gemcitabina più cisplatino. L'endpoint primario è stato raggiunto alla prima analisi ad interim predefinita in cui tislelizumab ha prolungato significativamente la sopravvivenza libera da progressione (Pfs) nella popolazione intent-to-treat (Itt) (Hr 0,52 [Ci 95% :0,38, 0,73] p
Scritto da: News News






07:30 - 09:30

Selezionata dallo staff di Radio K55
09:30 - 11:00

11:00 - 13:00

1
play_arrowJohn Lennon
 play_arrow
play_arrow
Imagine John Lennon

2
play_arrowEagles
 play_arrow
play_arrow
Hotel California Eagles

3
play_arrowThe Doors
 play_arrow
play_arrow
Light My Fire The Doors
Copyright | Radio K55 | Sede Legale: Via Lima, 41 - Roma - 00198 | P.IVA 16813261001 | Sede Operativa: Via Di Valleranello, 82 - Roma - 00128|
"WhatsAppa" con Noi